*Actualizó la alerta sanitaria publicada el 04 de abril de 2023 con relación la comercialización ilegal y la falsificación del producto
La Secretaría de Salud (SESA) del estado de Querétaro informa que la Comisión Federal para la Protección Contra Riesgos Sanitarios (COFEPRIS) actualizó la alerta sanitaria publicada el 04 de abril de 2023 con relación la comercialización ilegal y la falsificación del producto identificado como Mabthera (Rituximab) solución 500mg/50ml.
Como resultado del análisis sobre la nueva evidencia presentada por la empresa Productos Roche, S.A. de C.V., quien notificó la identificación de los números de lote H1079B02 y H7893B06, adicionales a los ya reportados de dicho producto.
El lote H7893B06 no es reconocido como fabricado para la empresa Productos Roche, S.A. de C.V., ni para ninguna de sus filiales, además de que no contiene el principio activo. Respecto al lote H1079B02, con fecha de caducidad 16 MAR 2024, presenta diversas anomalías en el empaque secundario.
Sugerencia: Inaugura SESA Foro de Seguridad del Paciente
Por lo que no se garantiza la seguridad, eficacia y calidad de los mismos, ya que se desconoce el origen de las materias primas, condiciones de fabricación, almacenamiento y transporte, representando un riesgo para la salud de la población.
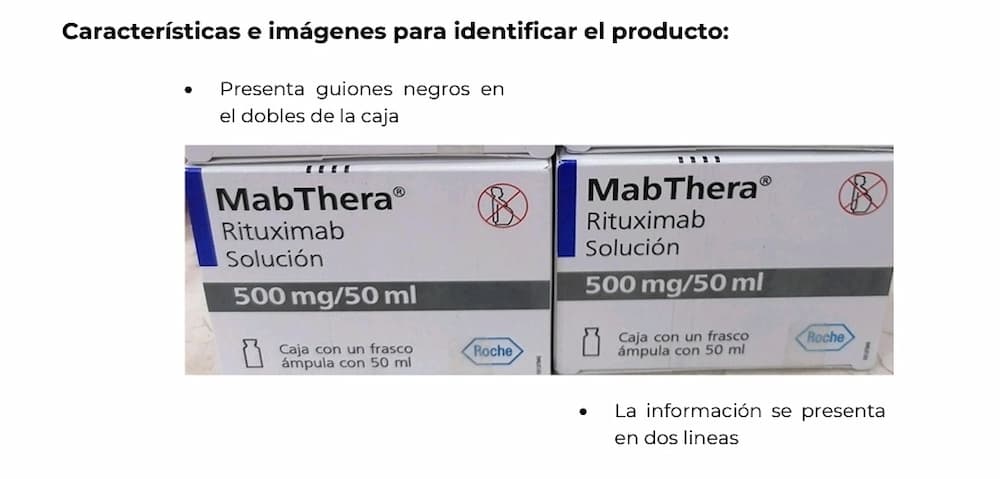
Características e imágenes para identificar el producto:
- Presenta guiones negros en el doblez de la caja.
- La información se presenta en dos líneas.
Por lo anterior, COFEPRIS emite las siguientes recomendaciones para el sector salud público y privado:
- Llevar a cabo las buenas prácticas en farmacia hospitalaria, mediante la revisión de los productos y en caso de identificar los números de lotes anteriormente indicados o alguna anomalía, realizar la denuncia sanitaria correspondiente.
- Revisar y validar la documentación con la que fue comercializado el producto y de encontrar inconsistencias con los lotes que se tienen en existencia notificarlo a la empresa titular del registro sanitario.
- En caso de traspasos entre instituciones públicas, dar la trazabilidad a la adquisición legal del producto y a la documentación con la que se realice la transacción, adicionalmente deberán garantizar las condiciones de almacenamiento.
- Si ha utilizado el producto antes referido y ha observado o le han reportado cualquier reacción adversa o malestar, reportarlo al correo electrónico: farmacovigilancia@cofepris.gob.mx
- La importación de medicamentos debe apegarse a lo establecido en la legislación sanitaria vigente.